
L’Agència Europea del Medicament (EMA) va anunciar a l’octubre de 2024 l’adopció de la tan esperada guia sobre la qualitat i l’equivalència dels productes tòpics. El document final es va redactar el 2018 i entrarà en vigor l’abril de 2025 amb el títol oficial ” Guia sobre la qualitat i l’equivalència dels productes cutanis d’aplicació local i acció local “.
Els nostres departaments de RIV i FIV i de Control de Qualitat han resumit els aspectes més rellevants de la guia de l’EMA pel que fa a la RIV i la FIV, dividint-los entre les recomanacions de qualitat i la secció d’equivalència terapèutica. Finalment, han compartit l’experiència de Kymos Group treballant en compliment d’aquesta des del seu esborrany anterior del document el 2018.
Quina és la nova guia de l’EMA sobre productes tòpics per al 2024?
Com el títol indica, aquesta guia fa referència als medicaments d’aplicació local i acció local per a ús cutani, però també pot ser rellevant per a altres productes com ara preparats per a ús auricular o ocular i productes vaginals d’acció local. Aquest nou reglament es divideix en recomanacions de qualitat i equivalència i introdueix un enfocament més estructurat per a l’avaluació dels productes cutanis.
La segona part relativa a l’equivalència no s’aplica als medicaments biològics, als medicaments a base d’herbes, als productes en què l’equivalència pel que fa a l’eficàcia es demostra mitjançant assajos clínics i als productes en què la forma farmacèutica de la prova i la de referència no són les mateixes. Aquesta exclusió és especialment important quan es tracta de formes de dosificació d’absorció sistèmica com ara els pegats transdèrmics.
Amb aquestes actualitzacions recents, l’EMA emfatitza un enfocament més estructurat i gradual que hauria de simplificar el procés de demostrar l’equivalència terapèutica centrant-se en mètodes in vitro (prova d’alliberament in vitro o IVRT i prova de permeació in vitro o IVPT) i farmacocinètics (PK) que presenten alternatives que estalvien costos i permeten eficiència en temps als estudis clínics.
Recomanacions de qualitat per a productes tòpics
Les recomanacions de qualitat de la guia s’apliquen a les noves sol·licituds d’autorització de comercialització i als canvis posteriors a l’aprovació de productes que no estan coberts per altres directrius o per les normes pertinents de la Farmacopea. Pel que fa a la IVRT i la IVPT, els aspectes més rellevants de la guia són:
Desenvolupament Farmacèutic
-
Desenvolupament de formulacions
El desenvolupament de la formulació ha d’estar alineat amb el QTTP (Perfil de Producte Obligatori de Qualitat), amb proves adequades per caracteritzar i controlar els CQA (Atributs Crítics de Qualitat) com ara la facilitat d’administració, la durada d’ús i el rendiment del producte com ara la dissolució, la IVRT i, si s’escau, la IVPT.
-
Caracterització del producte
La caracterització és necessària per facilitar la gestió del cicle de vida i, si cal, l’equivalència del producte. Les proves clau de rendiment han d’incloure la dissolució de suspensions, la IVRT i la IVPT si cal. S’ha de demostrar que el rendiment del producte és estable durant l’emmagatzematge.
Estratègia de control
Els criteris de qualitat crítics (CQA) crucials per al control de l’alliberament de fàrmacs s’han de gestionar acuradament, amb proves com ara la radiografia intraventricular (IVRT) i la teràpia intraventricular amb teràpia (IVPT) (si escau). Es poden utilitzar altres paràmetres (per exemple, microscòpia, DSC, reologia) si es demostra que són més discriminatoris a l’hora de controlar l’alliberament de fàrmacs. A més, qualsevol límit de prova de rendiment (per exemple, dissolució, IVRT) inclòs a l’especificació s’ha de justificar mitjançant referències a lots clínics amb eficàcia i seguretat provades.
Programa d’estabilitat
Les proves d’estabilitat han de garantir la qualitat i l’eficàcia del producte al llarg del temps, i la RTIV o altres proves de rendiment confirmen la consistència de la vida útil.
Recomanacions d’equivalència per a productes tòpics
Aquesta part de la guia s’aplica als nous productes cutanis que volen demostrar l’equivalència terapèutica amb un medicament existent. També és aplicable als canvis posteriors a l’aprovació quan es preveu un impacte potencial en la qualitat, la seguretat o l’eficàcia després d’una avaluació de riscos.
La guia també estableix específicament que «en el cas de sol·licituds que es basen en la literatura per demostrar la seguretat i l’eficàcia del medicament, la rellevància de la literatura ha d’estar avalada per dades que posin en relleu l’equivalència amb el producte descrit a la literatura».
Com s’ha esmentat anteriorment, l’EMA recomana un enfocament gradual per demostrar l’equivalència. Això permet als fabricants farmacèutics saber per endavant quines proves han de realitzar per als seus productes (formulacions simples com ara solucions o gels, o formulacions complexes com emulsions), i el seu objectiu principal és ometre els estudis clínics complets.
A l’hora de decidir quin enfocament i arbre de decisions seleccionar, l’EMA té en compte la composició qualitativa, la composició quantitativa i la caracterització fisicoquímica i estructural dels productes cutanis:
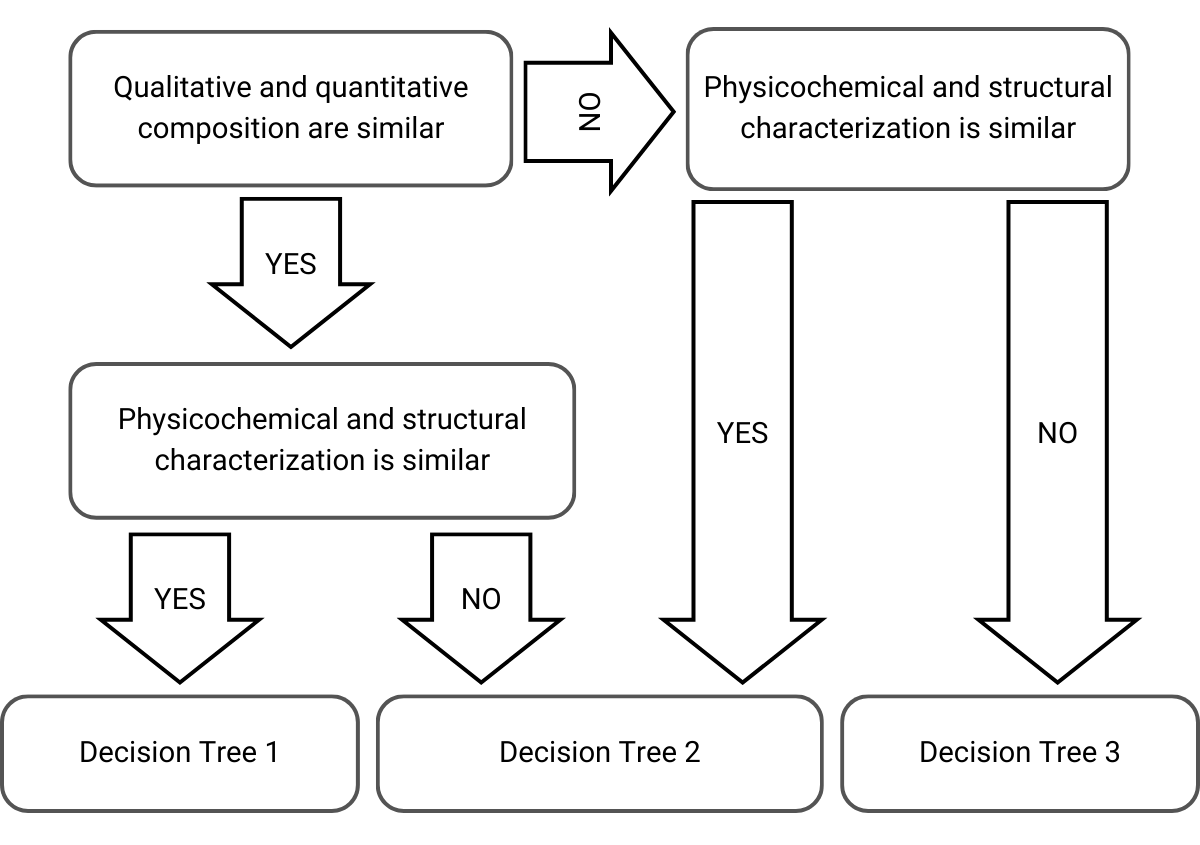
Figura 1) Selecció de l’arbre de decisió en l’enfocament pas a pas adaptat de la guia de l’EMA
Aleshores, depenent d’aquestes consideracions, l’enfocament gradual és el següent en els següents arbres de decisió que condueixen a ponts o rebutjos acceptables:
Arbre de decisió 1: Mateixa composició qualitativa i quantitativa, i mateixa caracterització fisicoquímica i estructural
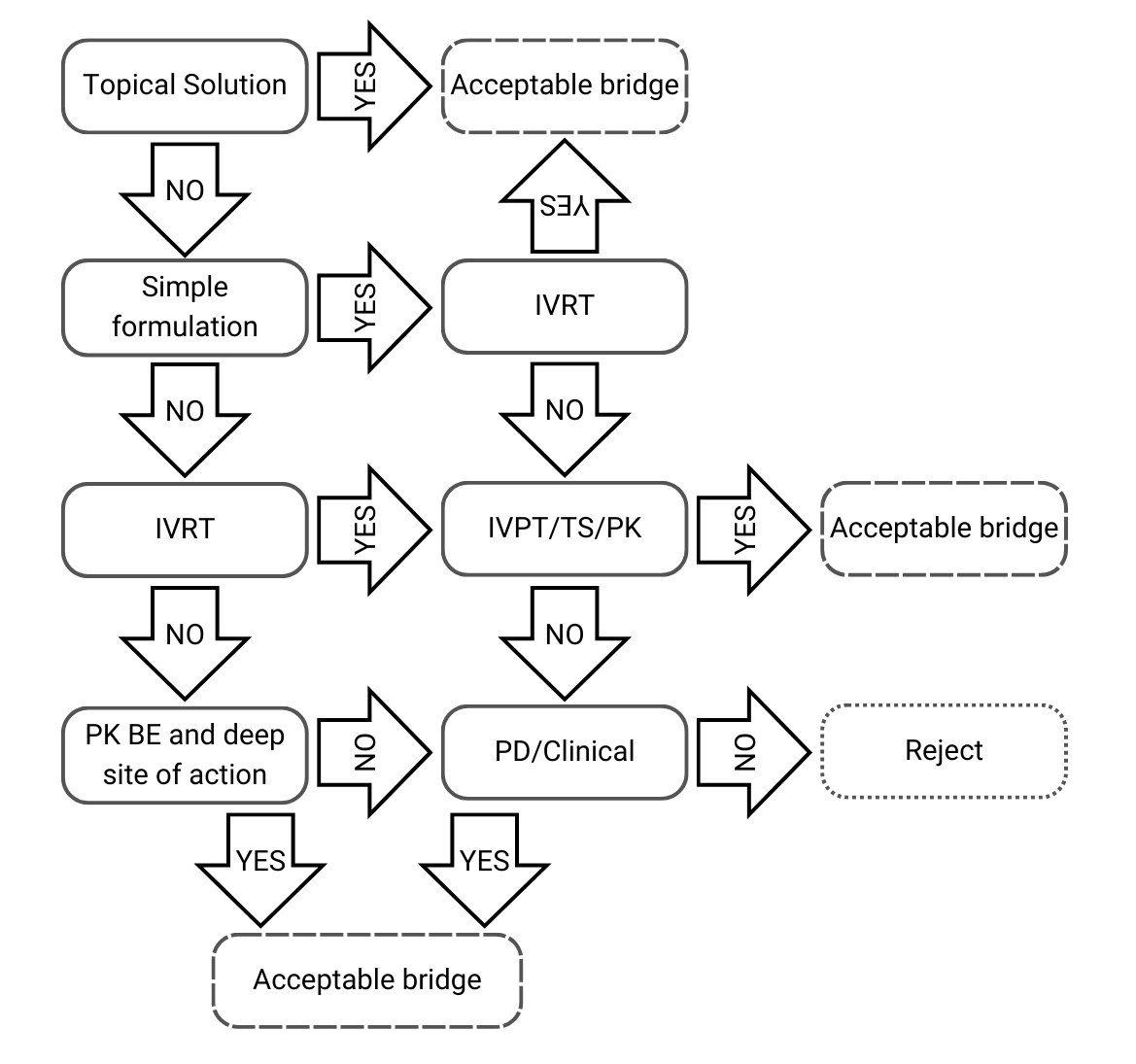
Figura 2) Arbre de decisió 1 de la guia de l’EMA
Arbre de decisió 2: Petites diferències en les composicions qualitatives i quantitatives, i/o caracterització fisicoquímica i estructural
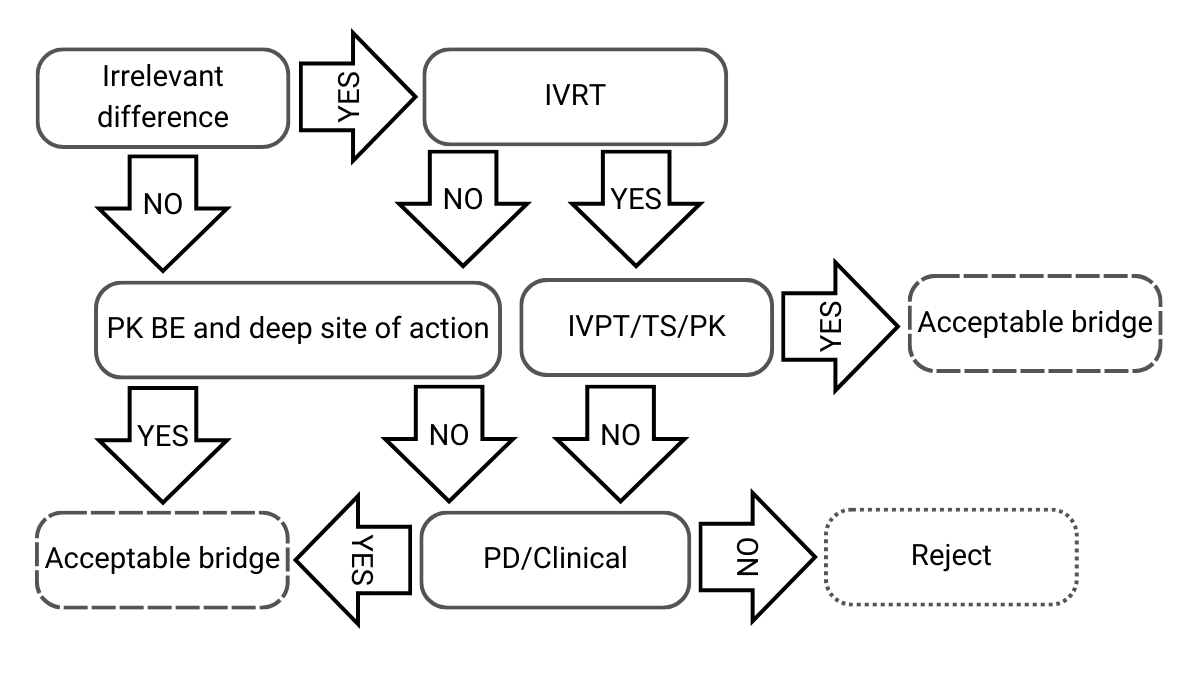
Figura 3) Arbre de decisió 2 de la guia de l’EMA
Arbre de decisió 3: Diferents composicions qualitatives i quantitatives i diferent caracterització fisicoquímica i estructural
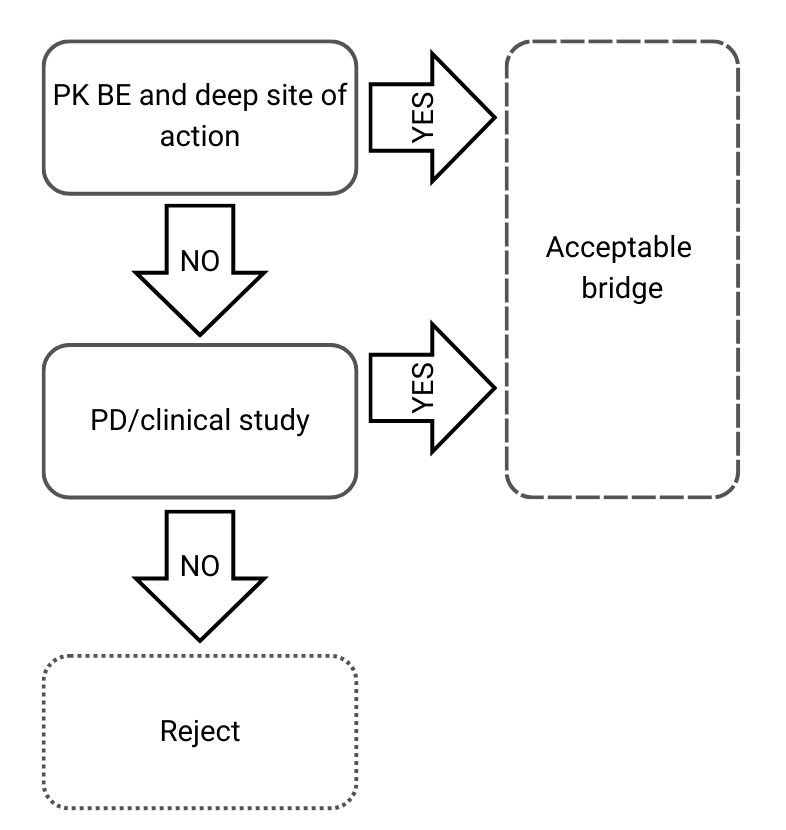
Figura 4) Arbre de decisió 3 de la guia de l’EMA
Com es veu en aquests arbres de decisió, depenent de les similituds entre els productes, l’EMA ofereix diferents enfocaments graduals que els fabricants haurien de tenir en compte.
Experiència de Kymos Group amb estudis IVRT i IVPT
Kymos Group compta amb un equip especialitzat que treballa amb tècniques d’alliberament de fàrmacs i productes tòpics des del 2017 i té una àmplia experiència en estudis de radioteràpia intravenosa (IVRT) i radioteràpia intravenosa (IVPT). Els nostres mètodes s’han desenvolupat d’acord amb l’esborrany d’aquesta mateixa guia del 2018, i els nostres científics ja estan familiaritzats amb aquesta versió final.
Hem dividit el nostre catàleg de serveis d’alliberament de fàrmacs i absorció percutània en dos grups principals:
- IVRT: Mesurem les quantitats i taxes d’alliberament de fàrmacs utilitzant membranes artificials per desenvolupar i validar mètodes per a diferents formulacions. Aquests mètodes es poden utilitzar en estudis comparatius per avaluar l’equivalència i també per realitzar el control de qualitat dels lots de fabricació.
- IVPT: Mesurem les quantitats permeades transdèrmiques, les taxes de flux i la distribució de capes amb mostres de pell per a estudis de bioequivalència. També podem ajudar en l’optimització i la comparació de formulacions amb estudis d’absorció percutània.
El nostre laboratori és una de les poques instal·lacions europees que ofereix assaigs d’absorció percutànies amb certificació GLP i GMP per a productes cutanis amb els instruments Phoenix de difusió vertical automatitzats més recents de Hanson (proves de cèl·lules de Franz).
Amb un coneixement profund de les noves directrius, el nostre equip científic està preparat per donar suport als clients des del desenvolupament de la formulació fins a la presentació reglamentària de noves sol·licituds de comercialització, però també per a productes cutanis que vulguin demostrar l’equivalència amb medicaments existents seguint l’enfocament gradual de l’EMA.
Conclusions
L’adopció de la nova guia de l’EMA sobre la qualitat i l’equivalència dels productes tòpics és un gran avenç cap a un enfocament més harmonitzat però també més estructurat de l’anàlisi d’aquests tipus de medicaments. Les seves recomanacions graduals per demostrar l’equivalència mitjançant tècniques com la radioteràpia intravenosa (IVRT) i la teràpia intravenosa amb teràpia intravenosa (IVPT) simplifiquen el procés de comercialització de nous genèrics sense la necessitat d’estudis clínics costosos i que requereixen molt de temps.
Com a CRO líder en IVRT i IVPT, Kymos Group i el seu equip estan preparats per donar suport als clients i socis en cada pas, garantint un camí sense problemes cap a l’aprovació de la comercialització a Europa segons les darreres directrius.
Si necessiteu més informació sobre la guia de l’EMA o qualsevol ajuda amb els vostres projectes d’absorció percutània, poseu-vos en contacte amb commercial@kymos.com . Estarem encantats de proporcionar-vos assessorament i suport detallats.

